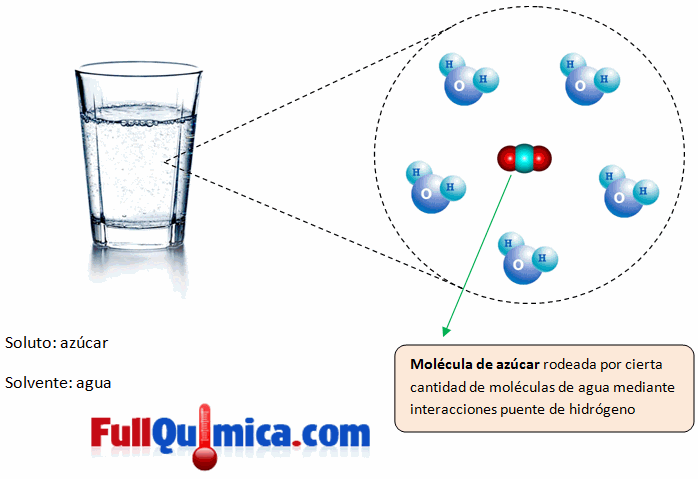
Una solución o una disolución es un método homogéneo en el cual se mezclan dos o mas componentes perdiendo cada uno sus características individuales principalmente formado por soluto y solvente, el soluto se encuentra en menor proporción y es lo que se disuelve, el solvente es la matriz que disuelve el soluto y se encuentra en mayor cantidad.
Dilucion: Es cuando una solución esta concentrada y se requiere obtener o convertir en una solución menos concentrada, es decir, debilitar la solución. los componentes de una solución no se pueden ver ya que los solutos toman el tamaño de átomos moléculas o iones.
Estado de las soluciones:
Gaseosas: tanto el soluto como el solvente es un gas (aire,gas natural como el metano)
Líquidas: el soluto puede ser un gas, un líquido o un sólido y el solvente un líquido. En el primer caso, se encuentran las bebidas gaseosas y el oxígeno en agua; en el segundo caso, se encuentran la gasolina y el vinagre y; en el último caso, la solución salina y el agua de mar.
Sólidas: El soluto puede ser un gas, un líquido o un sólido y el solvente un sólido. Cuando el soluto es un líquido y el solvente un sólido, entre las más comunes se encuentra la amalgama dental (mercurio en plata). Y cuando, tanto el soluto como el solvente son sólidos, se encuentran las aleaciones como el bronce (estaño en cobre) y el acero(carbono en hierro)
SOLUBILIDAD:
Solubilidad es la cualidad de soluble (que se puede disolver). Se trata de una medida de la capacidad de una cierta sustancia para disolverse en otra. La sustancia que se disuelve se conoce como soluto, mientras que aquella en la cual este se disuelve recibe el nombre de solvente o disolvente. La concentración, por otra parte, hace referencia a la proporción existente entre la cantidad de soluto y la cantidad de disolvente en una disolución.
CLASIFICACIÓN DE LAS SOLUCIONES:

SOLUCIÓN DILUIDA O INSATURADA: se dice que una solución es insaturada cuando aun su capacidad de disolver soluto aun no ha sido rebosada y que se encuentra aun con capacidad de recibir mas soluto a una temperatura dada.
SOLUCIÓN SATURADA: se habla de que una solución esta saturada cuando esta en el punto exacto donde no puede recibir mas soluto porque pasaría su capacidad de disolución.
SOLUCIÓN CONCENTRADA: Tiene una cantidad considerable de soluto en un volumen determinado.
SOLUCIÓN SOBRESATURADA: contiene más soluto del que puede existir en equilibrio a una temperatura y presión dadas. Si se calienta una solución saturada se le puede agregar más soluto; si esta solución es enfriada lentamente y no se le perturba, puede retener un exceso de soluto pasando a ser una solución sobresaturada. Sin embargo, son sistemas inestables, con cualquier perturbación el soluto en exceso precipita y la solución queda saturada.
TIPO DE DILUCIONES
* SERIADAS
* NO SERIADAS
* INDEPENDIENTES * QUÍMICAS

Sucesión de diluciones con incrementos progresivos y regulares en los cuales el factor de dilucion puede ser 1/2 1/4 1/8 1/16.
No seriadas, sucecion de diluciones con aumentos progresivos, no regulares en los cuales cada dilucion es menos concentradas que la interior en una proporción desconocida por ej:
1/2 1/4 1/64 1/2000
soluciones independiente; son las que no poseen ningún factor de dilucion y se revuelven con la formula ViCi = Vf Cf
- que cantidad de metanol al 95% necesito para preparar 2 litros litros de metanol al 60%
Vi?, Ci 95%, Vf 2 litros, Cf 60%
Vi= (2 litros x 60%)/95% = 1.26 lt metanol al 95% + 740 ml de H2O destilada.
UNIDADES DE CONCENTRACIÓN
La concentración es la relación que existe entre la cantidad de soluto y la cantidad de solución o de solvente. Esta relación se puede expresar de muchas formas distintas. Una de ellas se refiere a los porcentajes.
Porcentaje masa en masa o peso en peso, (%m/m):Es la cantidad en gramos de soluto por cada 100 gramos de solución. Ej: Una solución 12% m/m tiene 12 gramos de soluto en 100 gramos de solución.
Como fórmula, podemos expresar esta relación así:
%m/m = x 100
Porcentaje masa en volumen (%m/v): Es la cantidad en gramos de soluto por cada 100 ml de solución. Aquí como se observa se combina el volumen y la masa. Ej: Una solución que es 8% m/v tiene 8 gramos de soluto en 100 ml de solución.
Fórmula: % m/v = x 100
Porcentaje volumen en volumen (%v/v): Es la cantidad de mililitros o centímetros cúbicos que hay en 100 mililitros o centímetros cúbicos de solución. Ej: Una solución 16% v/v tiene 16 ml de soluto por 100 ml de solución.
Fórmula: % v/v = x 100
Otras formas son la Molaridad, la Normalidad y la Molalidad.
Es bueno recordad antes el concepto de mol. El mol de una sustancia es el peso molecular de esa sustancia expresada en gramos. Estos datos se obtienen de la tabla periódica de los elementos.
Sumando las masas de los elementos se obtiene la masa de la sustancia en cuestión.
Molaridad: Es la cantidad de moles de soluto por cada litro de solución. Como fórmula:
M = n/V M = M: Molaridad. n: Número de moles de soluto. V: Volumen de solución expresado en litros.
Normalidad: Es la cantidad de equivalentes químicos de soluto por cada litro de solución. Como fórmula: N = n eq/V N = Normalidad. n eq. : Número de equivalentes del soluto. V: Volumen de la solución en litros.
Molalidad: Es la cantidad de moles de soluto por cada 1000 gramos de solvente. En fórmula: m = n/kgs solvente m = Molalidad. n: Número de moles de soluto por Kg = 1000 gramos de solvente o 1 kg de solvente.

No hay comentarios:
Publicar un comentario