Analisis from Yarlinys Marin
ANÁLISIS

jueves, 29 de octubre de 2015
domingo, 25 de octubre de 2015
domingo, 25 de octubre de 2015
SOLUCIONES
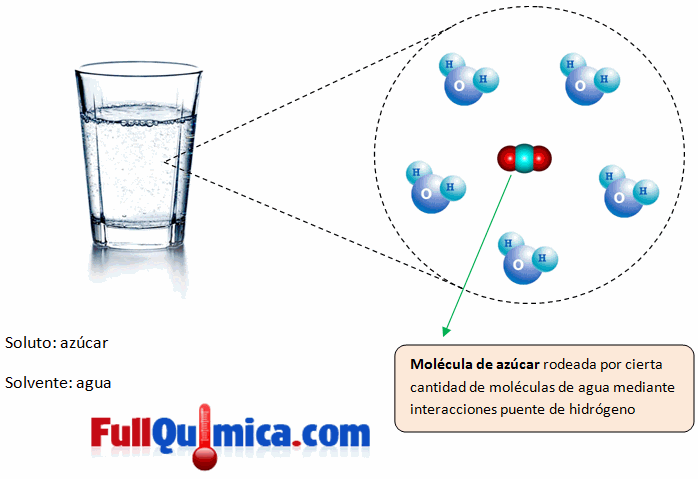
Una solución o una disolución es un método homogéneo en el cual se mezclan dos o mas componentes perdiendo cada uno sus características individuales principalmente formado por soluto y solvente, el soluto se encuentra en menor proporción y es lo que se disuelve, el solvente es la matriz que disuelve el soluto y se encuentra en mayor cantidad.
Dilucion: Es cuando una solución esta concentrada y se requiere obtener o convertir en una solución menos concentrada, es decir, debilitar la solución. los componentes de una solución no se pueden ver ya que los solutos toman el tamaño de átomos moléculas o iones.
Estado de las soluciones:
SOLUBILIDAD:
CLASIFICACIÓN DE LAS SOLUCIONES:

SOLUCIÓN DILUIDA O INSATURADA: se dice que una solución es insaturada cuando aun su capacidad de disolver soluto aun no ha sido rebosada y que se encuentra aun con capacidad de recibir mas soluto a una temperatura dada.
SOLUCIÓN SATURADA: se habla de que una solución esta saturada cuando esta en el punto exacto donde no puede recibir mas soluto porque pasaría su capacidad de disolución.
SOLUCIÓN CONCENTRADA: Tiene una cantidad considerable de soluto en un volumen determinado.

Sucesión de diluciones con incrementos progresivos y regulares en los cuales el factor de dilucion puede ser 1/2 1/4 1/8 1/16.
No seriadas, sucecion de diluciones con aumentos progresivos, no regulares en los cuales cada dilucion es menos concentradas que la interior en una proporción desconocida por ej:
1/2 1/4 1/64 1/2000
soluciones independiente; son las que no poseen ningún factor de dilucion y se revuelven con la formula ViCi = Vf Cf
- que cantidad de metanol al 95% necesito para preparar 2 litros litros de metanol al 60%
Vi?, Ci 95%, Vf 2 litros, Cf 60%
Vi= (2 litros x 60%)/95% = 1.26 lt metanol al 95% + 740 ml de H2O destilada.
Una solución o una disolución es un método homogéneo en el cual se mezclan dos o mas componentes perdiendo cada uno sus características individuales principalmente formado por soluto y solvente, el soluto se encuentra en menor proporción y es lo que se disuelve, el solvente es la matriz que disuelve el soluto y se encuentra en mayor cantidad.
Dilucion: Es cuando una solución esta concentrada y se requiere obtener o convertir en una solución menos concentrada, es decir, debilitar la solución. los componentes de una solución no se pueden ver ya que los solutos toman el tamaño de átomos moléculas o iones.
Estado de las soluciones:
Gaseosas: tanto el soluto como el solvente es un gas (aire,gas natural como el metano)
Líquidas: el soluto puede ser un gas, un líquido o un sólido y el solvente un líquido. En el primer caso, se encuentran las bebidas gaseosas y el oxígeno en agua; en el segundo caso, se encuentran la gasolina y el vinagre y; en el último caso, la solución salina y el agua de mar.
Sólidas: El soluto puede ser un gas, un líquido o un sólido y el solvente un sólido. Cuando el soluto es un líquido y el solvente un sólido, entre las más comunes se encuentra la amalgama dental (mercurio en plata). Y cuando, tanto el soluto como el solvente son sólidos, se encuentran las aleaciones como el bronce (estaño en cobre) y el acero(carbono en hierro)

SOLUBILIDAD:
Solubilidad es la cualidad de soluble (que se puede disolver). Se trata de una medida de la capacidad de una cierta sustancia para disolverse en otra. La sustancia que se disuelve se conoce como soluto, mientras que aquella en la cual este se disuelve recibe el nombre de solvente o disolvente. La concentración, por otra parte, hace referencia a la proporción existente entre la cantidad de soluto y la cantidad de disolvente en una disolución.
CLASIFICACIÓN DE LAS SOLUCIONES:

SOLUCIÓN DILUIDA O INSATURADA: se dice que una solución es insaturada cuando aun su capacidad de disolver soluto aun no ha sido rebosada y que se encuentra aun con capacidad de recibir mas soluto a una temperatura dada.
SOLUCIÓN SATURADA: se habla de que una solución esta saturada cuando esta en el punto exacto donde no puede recibir mas soluto porque pasaría su capacidad de disolución.
SOLUCIÓN CONCENTRADA: Tiene una cantidad considerable de soluto en un volumen determinado.
SOLUCIÓN SOBRESATURADA: contiene más soluto del que puede existir en equilibrio a una temperatura y presión dadas. Si se calienta una solución saturada se le puede agregar más soluto; si esta solución es enfriada lentamente y no se le perturba, puede retener un exceso de soluto pasando a ser una solución sobresaturada. Sin embargo, son sistemas inestables, con cualquier perturbación el soluto en exceso precipita y la solución queda saturada.
TIPO DE DILUCIONES
* SERIADAS
* NO SERIADAS
* INDEPENDIENTES * QUÍMICAS

Sucesión de diluciones con incrementos progresivos y regulares en los cuales el factor de dilucion puede ser 1/2 1/4 1/8 1/16.
No seriadas, sucecion de diluciones con aumentos progresivos, no regulares en los cuales cada dilucion es menos concentradas que la interior en una proporción desconocida por ej:
1/2 1/4 1/64 1/2000
soluciones independiente; son las que no poseen ningún factor de dilucion y se revuelven con la formula ViCi = Vf Cf
- que cantidad de metanol al 95% necesito para preparar 2 litros litros de metanol al 60%
Vi?, Ci 95%, Vf 2 litros, Cf 60%
Vi= (2 litros x 60%)/95% = 1.26 lt metanol al 95% + 740 ml de H2O destilada.
UNIDADES DE CONCENTRACIÓN
La concentración es la relación que existe entre la cantidad de soluto y la cantidad de solución o de solvente. Esta relación se puede expresar de muchas formas distintas. Una de ellas se refiere a los porcentajes.
Porcentaje masa en masa o peso en peso, (%m/m):Es la cantidad en gramos de soluto por cada 100 gramos de solución. Ej: Una solución 12% m/m tiene 12 gramos de soluto en 100 gramos de solución.
Como fórmula, podemos expresar esta relación así:
%m/m = x 100
Porcentaje masa en volumen (%m/v): Es la cantidad en gramos de soluto por cada 100 ml de solución. Aquí como se observa se combina el volumen y la masa. Ej: Una solución que es 8% m/v tiene 8 gramos de soluto en 100 ml de solución.
Fórmula: % m/v = x 100
Porcentaje volumen en volumen (%v/v): Es la cantidad de mililitros o centímetros cúbicos que hay en 100 mililitros o centímetros cúbicos de solución. Ej: Una solución 16% v/v tiene 16 ml de soluto por 100 ml de solución.
Fórmula: % v/v = x 100
Otras formas son la Molaridad, la Normalidad y la Molalidad.
Es bueno recordad antes el concepto de mol. El mol de una sustancia es el peso molecular de esa sustancia expresada en gramos. Estos datos se obtienen de la tabla periódica de los elementos.
Sumando las masas de los elementos se obtiene la masa de la sustancia en cuestión.
Molaridad: Es la cantidad de moles de soluto por cada litro de solución. Como fórmula:
M = n/V M = M: Molaridad. n: Número de moles de soluto. V: Volumen de solución expresado en litros.
Normalidad: Es la cantidad de equivalentes químicos de soluto por cada litro de solución. Como fórmula: N = n eq/V N = Normalidad. n eq. : Número de equivalentes del soluto. V: Volumen de la solución en litros.
Molalidad: Es la cantidad de moles de soluto por cada 1000 gramos de solvente. En fórmula: m = n/kgs solvente m = Molalidad. n: Número de moles de soluto por Kg = 1000 gramos de solvente o 1 kg de solvente.
sábado, 3 de octubre de 2015
viernes, 25 de septiembre de 2015
ELECTROFORESIS
Electroforesis.
La electroforesis es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar biomoleculas según su tamaño y carga eléctrica a través de una matriz gelatinosa.
También es una técnica para la separación de moléculas que se basa en la migración de solutos iónicos bajo la influencia de un campo eléctrico; estas partículas migran hacia el cátodo o ánodo, en dependencia de una combinación de su carga, peso molecular y estructura tridimensional, la ventaja de la electroforesis es la separación, visualización y cuantificación del número de proteínas de una solución, pero esta también afecta la estructura de las proteínas por lo tanto, afecta a la función de la misma.
Métodos electroforéticos zonales.
Son los más comunes, dada su alta aplicabilidad en diferentes campos. Son útiles para lograr la separación de mezclas complejas. Se aplican pequeñas cantidades de la disolución de proteínas a un soporte sólido, que se impregna con una solución tampón. Los soportes son en general polímeros y forman un gel poroso que restringe el movimiento de las moléculas a través del medio durante la electroforesis y disminuyen los flujos de convección del solvente.
Como soporte han sido utilizados papel (celulosa), almidón, poliacrilamida, agarosa y acetato de celulosa, entre otros. Este método tiene gran poder resolutivo por que se aplica una cantidad pequeña de proteína a una zona estrecha, mientras que la longitud del trayecto es mucho mayor que la zona de aplicación. El equipamiento requerido es simple, fuente de poder, cubeta vertical u horizontal donde se colocan el soporte y dos electrodos.
Electroforesis en gel de poliacrilamida.
Los geles de poliacrilamida se forman por polimerización de la acrilamida por acción de un agente entrecuzador, es químicamente inerte, de propiedades uniformes, capaz de ser preparado de forma rápida y reproducible. Forma, además, geles transparentes con estabilidad mecánica, insolubles en agua, relativamente no iónicos y que permiten buena visualización de las bandas durante un tiempo prolongado. Además tiene la ventaja de que variando la concentración de polímeros, se puede modificar de manera controlada en el tamaño del poro, lamentablemente cada vez se emplea menos en diagnostico debido a su neurotoxocidad.
Electroforesis en geles de agarosa.
La agarosa es un polisacárido (originalmente obtenido de algas, como el agar-agar, pero de composición homogénea), cuyas disoluciones (típicamente de 0.5 a 2 %) poseen la propiedad de permanecer liquidas por encima de 50 grados C y formar un gel, semisólido al enfriarse. Este gel está constituido por una matriz o trama tridimensional de fibras poliméricas embebida en gran cantidad de medio líquido, que retarda el paso de las moléculas, se usa usualmente para separar moléculas grandes de alrededor 20.000 nucleótidos.
Factores que afectan la electroforesis.
- Carga neta.
- Tamaño.
- Intensidad del campo eléctrico.
- Temperatura.
- Medio soporte.
- Buffer.
miércoles, 23 de septiembre de 2015
Espectrofotometria
Muchas técnicas analíticas que se emplean en laboratorios de química clínica incorporan los principios de instrumentación espectrofotométrica. La espectrofotometría se utilizan los patrones característicos de absorbancia de radiación electromagnética para identificar los analitos de interés. Cuando se conoce el patrón espectral se usa la longitud de onda luminosa la cual la absorbancia es máxima, cuantificar dicha sustancia en solución.
Características de la luz.
Debido que la espectrofotometría comprende mediciones con detectores de la radiación electromagnética que se trasmite, es fundamental conocer las principales características de la radiación electromagnética, la luz es una forma visible de radiación electromagnética; o sea que se comporta como si tuviera campos eléctricos y magnéticos oscilados en planos perpendiculares entre si.
Características de la longitud de onda.
La luz, como toda radiación electromagnética, está formada de fotones o paquetes de energía (E) que viajan en ondas. El espectro electromagnético se describe en términos de longitud de onda.
La longitud de onda del espectro electromagnético es la distancia entre los máximos de ondas sucesoras. En el sistema internacional se mide en nanómetros (nm), el número de ondas por el segundo se denomina frecuencia. La longitud de onda se relaciona inmensamente con la energía, mientras mayor es la longitud de onda es menor el número de fotones que contiene. En otras palabras la longitud de onda larga es de baja energía, de manera similar la longitud de onda corta posee más energía.
Espectro electromagnético.
Es el rango de todas las radiaciones electromagnéticas posibles. El espectro de un objeto es la distribución característica de la radiación electromagnética de ese objeto.
El espectro electromagnético se extiende desde las bajas frecuencias usadas para la radio moderna (extremo de la onda larga) hasta los rayos gamma (extremo de la onda corta), que cubren longitudes de onda de entre miles de kilómetros y la fracción del tamaño de un átomo. Se piensa que el límite de la longitud de onda corta está en las cercanías de la longitud Planck, mientras que el límite de la longitud de onda larga es el tamaño del universo mismo, aunque en principio el espectro sea infinito y continuo.
Espectro ultravioleta.
La región UV se define como el rango de longitudes de onda de 195 a 380nm. Posee una región de energía muy alta, provoca daños al ojo humano, la región UV es importante para la determinación cualitativa y cuantitativa de compuestos orgánicos.
Espectro visible.
Se describe como el rango de longitudes de ondas visibles a simple vista. Esta región va de 380 a 700 nm, se obtiene un espectro continuo con un color visible distinto que corresponde a determinada porción de longitud de onda.
El color visible de una solución corresponde a la longitud de onda que trasmite, no que se absorbe, el color que se absorbe es el complementario del color que se trasmite, por tanto, para efectuar mediciones de absorción es necesario utilizar longitud de onda a la cual la solución colorida absorbe luz.
Radiación infrarroja.
Se emplea sobre todo en análisis toxicológicos.
La mayoría de las medidas espectrofotométricas se basan en la ley de Beer, la concentración de una sustancia es directamente proporcional a la cantidad de luz absorbida, e inversamente proporcional al logaritmo de la luz trasmitida y se expresa matemáticamente así.
A = a.b.c. = 2 – log % T donde:
A = absorbancia.
a = absortividad o coeficiente de absorción.
b = longitud de paso de la luz en centímetros.
c = concentración de la sustancia en interés.
%T = porcentaje de transmitancia.
Absorbancia.
Este compuesto es sinónimo de densidad óptica, se define como la cantidad de energía radiante que una sustancia absorbe a determinada longitud de onda.
Transmitancia.
Es la cantidad de energía radiante que trasmite o deja pasar una sustancia a una determinada longitud de onda.
Espectrofotometría:
Es la medición de la intensidad de la energía radiante en estrecho intervalo de longitud de onda del espectro. Para la selección de la longitud de onda se utilizan rejillas de difracción o prisma.
Fotometría
Es el procedimiento por el cual se efectúan mediciones de energía radiante utilizando filtro para aislar parte del espectro.
Pruebas colorimétricas.
Blanco reactivo
.
Casi todos los reactivos poseen una coloración que tendrán una absorbancia que tienen que ver con el color original que este trae, por lo tanto necesitamos eliminarla para no aumentar la absorbancia de la muestra. Así que sirve para eliminar la absorbancia propia del reactivo, esta resta puede realizarse de manera manual o automáticamente con el fotocolorímetro o espectrofotómetro.
Blanco de muestra.
Es un tubo que se monta utilizando agua destilada y se usa para eliminar la absorbancia propia de la muestra en los casos que se esta presente, hemolisis, ictericia o lipemia.
Blanco de aire.
Es realizarle un cero de absorbancia al equipo para eliminar cualquier inferencia.
Estándar.
Es una solución patrón que tiene una concentración conocida de un determinado metabolito y se utiliza para comparar su color con el de la muestra, y lo más importante, para calcular la concentración del metabolito en estudio en la muestra examinada, a través de la siguiente formula en la ley de Beer.
Concentración = absorbancia de la muestra
De la muestra ………………………………….. X la concen del estándar.
Absorbancia del estándar.
martes, 22 de septiembre de 2015
Cromatografia
La cromatografía es uno de los principales métodos para la separación de especies químicas estrechamente relacionadas en mezclas complejas. La cromatografía es un método físico de separación basado en la distribución de los componentes de una mezcla entre dos fases inmiscibles, una fija o estacionaria y otra móvil.
En todas las separaciones cromatográficas la muestra se disuelve en una fase móvil, que puede ser un gas un líquido o un fluido supercrítico. Esta fase móvil se hace pasar a través de una fase estacionaria inmiscible, la cual se mantienen fija en una columna o sobre una superficie sólida. Las fases se eligen de tal forma que los componentes de la muestra se distribuyen de modo distinto entre la fase móvil y la fase estacionaria. Aquellos componentes que son retenidos con más fuerza por la fase estacionaria se mueven lentamente con el flujo; por el contrario los componentes que unen débilmente a la fase estacionaria, se mueven con rapidez. Como consecuencia de la distinta movilidad, los componentes de la muestra se separan en bandas discriminadas que pueden analizarse cualitativa y/o cuantitativamente.
domingo, 30 de agosto de 2015
TOMA DE MUESTRA SANGUÍNEA
procedimiento que permite acceder al torrente sanguíneo para extraer una pequeña muestra de sangre, que sera utilizada en diversas pruebas.
COMPOSICIÓN DE LA SANGRE
se pueden obtener muestras: De sangre venosa y de sangre arterial
en la sangre venosa las sustancias a analizar estas solubles y dispersas
en este caso la sangre es de color oscuro.
en la sangre arterial útil en pO2, pCO2 y PH del plasma y la sangre arterial
tiene un color rojo vivo.
propósitos de la toma de muestra
* Medir los componentes de la sangre
* Monitorizar la respuesta de un cliente a una terapia
* Determinar el grupo sanguíneo del cliente
PREPARACIÓN DE MATERIALES
Precauciones de bioseguridad
La manipulación inapropiada puede convertirse en una fuente de
riesgo biológico para las personas que están en contacto o para
el medio ambiente. Utilizar los elementos de protección personal
necesarios para evitar exposición con riesgo biológico, de acuerdo
con la fuente de la muestra.
• Protección ocular: gafas o mascarilla con visera.
• Mascarilla, alcohol al 70%,algodón, esparadrapo, jeringa de 5ml
• Guantes, torniquete, tubos al vacío con anticongelante edta (k3), (NA2), u otro anticoagulante
• Bata.
• Contenedores para especímenes, a prueba de fugas y de fácil
sellamiento.
Cumplir con las recomendaciones de manejo de elementos cortopunzantes:
• No reenfundar agujas.
• Disponer y utilizar adecuadamente el contenedor para cortopunzantes (guardián)
• No transportar jeringas con agujas. Se recomienda transferir el
aspirado a un tubo estéril.
En caso de accidente con riesgo biológico, avisar inmediatamente
según las recomendaciones del protocolo de accidente de trabajo
con riesgo biológico institucional.
Preparación de elementos
Una vez conocida la solicitud del tipo de examen, se debe preparar
el equipo necesario para la obtención, la conservación y el
transporte correctos de la muestra. Las propiedades biológicas de
esta pueden ser alteradas por variables medioambientales como:
tiempo, contenedor, contaminación externa.
TUBO CON TAPA ROJA
Tubo para serología, sin anticoagulante, en plástico, transparencia cristal, con el interior
recubierto de silicona y activador de coágulo, con un volumen aproximado de aspiración de 4.0
ml, de 13 por 75 mm, con tapa de seguridad HEMOGARD y tapón siliconado hemorrepelente.
TUBO CON TAPA AZUL
Tubo para hemostasia full draw, en vidrio con fondo de doble espesor, con buffer
citrato 0.129 M equivalente a una concentración de citrato de sodio al 3.8 %, con un volumen
aproximado de aspiración de 4.5 ml, de 13 por 75 mm, con tapa de seguridad HEMOGARD y
tapón siliconado hemorrepelente, con el interior recubierto con doble capa de silicona. Para pruebas de coagulación.
TUBO CON TAPA LILA
Tubo para hematología, en plástico, transparencia cristal, con el interior recubierto de
silicona, y K2 EDTA pulverizado en las paredes del tubo, con un volumen aproximado de
aspiración de 2.0 ml, de 13 . 75 mm, con tapa de seguridad HEMOGARD y tapón siliconado
hemorrepelente.
TUBO CON TAPA AMARILLA
Tubo para serología, sin anticoagulante, con gel separador, en vidrio con fondo de
doble espesor, con el interior recubierto de silicona y activador de coágulo, con un volumen
aproximado de aspiración de 6.0 ml, de 13 por 100 mm, con tapa de seguridad HEMOGARD y
tapón siliconado hemorrepelente.
TUBO CON TAPA NEGRA
Tubo para ERS, (ERITROSEDIMENTACION) en vidrio con fondo de doble espesor, con buffer citrato 0.129 M
equivalente a una concentración de citrato de sodio al 3.8 %, con un volumen aproximado de
aspiración de 2.4 ml, de 13 . 75 mm, con tapa de seguridad HEMOGARD y tapón siliconado
hemorrepelente. Útil para medir la velocidad de sedimentacion globular.
TUBO CON TAPA CELESTE
Tubo con 143 unidades USP de Heparina de Sodio para el estudio de traza de metales.
El tubo es de vidrio con fondo de doble espesor , con un volumen aproximado de aspiración de
7.0 ml, de 13 por 100 mm. y posee cantidades mínimas de elementos traza (zinc, magnesio,
hierro, plomo, calcio, cobre, arsénico, manganeso, cadmio, cromo y antimonio) por lo que no
interfieren con el análisis. Con tapón Hemogard que está libre de metales.
PREPARACIÓN DEL PACIENTE
* Ayuno del paciente
* Sobre el ejercicio muscular
* Preparación psicológica
* posición del paciente
ATENCIÓN DEL PACIENTE: Todas las muestras deben ir acompañadas de una solicitud debidamente formulada. La solicitud debe contener la siguiente información:
a) La identificación completa del paciente:
Nombre completo
Sexo
Número de cédula o seguro social
Datos para su localización Sala y número de cama si está hospitalizado
Número de teléfono si es ambulatorio
b) Médico solicitante:
Nombre completo
Especialidad
Registro
c) Pruebas que se realizarán Es deseable que la solicitud incluya información clínica de utilidad
Diagnóstico
Ingestión de drogas
Restricciones especiales
d) Fecha de orden y fecha de colección
e) Hora de extracción
SITIOS DE PUNCIÓN
* cuero cabelludo venas superficiales del cráneo
* cuello: yugular externa
* axila: vena axilar
* fosa antecubital: vena cefálica, basílica y mediana
* antebrazo: vena radial, cubital y mediana
* mano: venas dorsales de la mano
* tobillo: safena externa y interna
* pie: venas dorsales del pie
LA PALPACIÓN:
Antes de proceder a puncionar, se debe escoger la vena. La mejor manera es realizando una
palpación de las mismas para esa decisión. Para ello coloque el torniquete 3 a 4 pulgadas por arriba
del sitio seleccionado, para visualizarlas mejor. Debe tener presente en no mantener el torniquete
por más de 3 minutos, para evitar la hemoconcentración.
Las venas más utilizadas para la venopunción, están localizadas en el área antecubital. Entre éstas
tenemos:
a) Vena Cubital: Es la más larga y gruesa de todas y es la preferida por bordear la
musculatura del brazo.
b) Vena Cefálica: Tiene iguales características de la anterior, pero es un poco menos
gruesa.
c) Vena Basílica: Es más pequeña que las anteriores. Esta vena está cerca de la arteria
braquial, por lo que su punción es riesgosa y su área es más sensible y dolorosa para el
paciente.
Al palpar hágalo con la punta de sus dedos, tratando de seguir el rastro de las venas. Aquí también son
útiles sus conocimientos en la anatomía de las venas de las extremidades superiores. En ocasiones si no
visualiza la vena, puede forzar la sangre dentro de la vena a través de un suave masaje de abajo hacia
arriba.
14.- Cnnnnolocar una torunda de algodón secla en un contenedor.
17.- Ve
* Colocar el torniquete
* Introducir la aguja dejando el espacio de un angulo de 45° entre el brazo y la jeringa
* Soltar el torniquete una vez que la sangre empiece a fluir
* Introducir la muestra de sangre al tubo correspondiente por sus respectivas paredes y quitando la aguja de la jeringa
* Etiquetar los tubos, nombre y fecha de la extracción sanguínea
* Depositar la aguja en donde se debe en un guardián
PRECAUCIONES
A la hora de realizar una toma de muestras hay que evitar errores ya que un error de estos puede ser un error fatal como el de confundir o olvidar poner el nombre del paciente.
* No dejar una muestra sin ser etiquetada
* Etiquetadas con el nombre del paciente equivocado
* Muestras diluidas
* Muestras concentradoras
* Muestras coaguladas e insuficientes
* Aditivo o anticoagulante inadecuado
* Muestras hemolizadas
* Tener el equipo en buenas condiciones ya que, esto disminuye y evita el riesgo en relación a accidentes y complicaciones
* y por ultimo no puncionar en zonas afectadas ya sea donde se encuentren lunares, verrugas, o sitios del cuerpo golpeados.
MATERIALES Y EQUIPOS DE LABORATORIO
para abordar nuestro tema principal debemos primero hablar sobre el laboratorio. El laboratorio clínico es el lugar donde se realizan análisis clínicos que contribuyen al estudio, prevención, diagnostico y tratamiento de los problemas de salud de los pacientes.
existen dos tipos de laboratorios, están los de rutina y los laboratorios especializados.
en los laboratorios de rutina existen cuatro áreas básicas:
* hematología
* inmunología
* microbiología
* química clínica
los laboratorios de especialidad están compuestos por equipos sofisticados los cuales ayudan a realizar estudios mas especializados que requieren equipos especializado y personal calificado. Por ejemplo se utilizan en estos casos:
* estudios genéticos
* cromatografías de alta resolución
* amplificación de ácidos nucleicos
* citrometría de flujo
respecto a la organización del laboratorio, este se puede seccionar en varias áreas especificas sin intervenir en los procesos que se este realizando en otra área.
encontramos la sala de espera y recepción, el área de toma de muestras es donde se toma la muestra a los pacientes para luego distribuirla a las diferentes secciones del laboratorio.
En el área de hematología se realizan tres tipos de pruebas las cuales podemos resumir de esta manera:
* pruebas de coagulación
* pruebas de contabilidad sanguínea
* pruebas de morfología sanguínea
En el área de química clínica podemos dividir los exámenes en tres grupos:
* química sanguínea de rutina
* exámenes generales de orina
* determinación de reserva electrolítica y bióxido de carbono en la sangre
En el área de microbiologia también se puede dividir en tres tipos de exámenes:
* coproparasitología: investiga la presencia de parásitos en la materia fecal
* bacteriología: estudia la presencia o actividad de microorganismos en la sangre, orina, jugos gástricos, materia fecal.
En el área de Inmunología se realizan pruebas sobre anticuerpos que revelan la actividad y presencia de microorganismos en el cuerpo.
Equipos de laboratorio
En el laboratorio se encuentran distintos equipos los cuales son de gran utilidad en el trabajo ya que nos permiten realizar mas rápido y con mayor efectividad los procesos. Entre estos equipos se encuentran:
* Microscopio: El microscopio es utilizado para observar microorganismos que no pueden ser observados a simple vista. es un instrumento fundamental en un laboratorio clinico
* Centrifuga: La centrifuga es un equipo de laboratorio que genera movimientos de rotación, tiene el objetivo de separar los componentes que constituyen una sustancia.
* Balanza analítica: es un instrumento que sirve para pesar y medir sustancias con un alto grado de exactitud.
* Espectofotometro: Un espectofotometro es un instrumento usado en el análisis químico que sirve para medir, en función de la longitud de onda, la relación entre valores de una misma magnitud fotométrica relativos a dos haces de radiaciones y la concentración o reacciones químicas que se miden en una muestra. es utilizado en los laboratorios de química para la cuantificacion de sustancias y microorganismos.
* Esterilizadores: El autoclave es un equipo de laboratorio que se utiliza para esterilizar. por esterilizar se entiende la destrucción o eliminación de toda forma de vida microbiana (incluyendo esporas) presente en objetos inanimados mediante procedimientos físicos, químicos o gaseosos.
* Autoanalizador automático:
Un autoanalizador automático es una máquina de un laboratorio clínico diseñado para medir diferentes sustancias químicas y otras características en un número de muestras biológicas, con una asistencia humana mínima.
Estas mediciones de sangre y otros líquidos pueden usarse para el diagnóstico de la enfermedad.
* Rotador serologico: El rotador serologico es un equipo medico utilizado en los laboratorios; para la mezcla, la homogeneizacion y/o preparación de combinaciones de sustancias .
Por otra parte en el laboratorio están los materiales los cuales son fundamentales en este para los procesos de análisis de sustancias.
Existen diferentes clases de materiales, estos se clasifican en:
* material de fabricación
* según su función
* material volumetrico
* material no volumetrico
Los elementos de uso común en el laboratorio se clasifican según el material por el cual estén constituidos. entre los mas destacados están:
* Metal: llamado
de sostén (y calentamiento). Cuando se quiere armar un aparato y se deben
sostener las diferentes piezas que lo componen, y que generalmente son de
vidrio, se utilizan aparatos de hierro, de bronce o de algunas aleaciones
metálicas resistentes a los ataques químicos, como ser aleaciones con
molibdeno. Estos son algunos ejemplos de instrumentos hecho en este material
* Vidrio: Es el material —que
se utiliza para fabricar elementos de laboratorio debido a su fácil limpieza y
su neutralidad frente a los reactivos químicos. También cabe resaltar su resistencia a altas temperaturas, este es uno de los motivos por los cuales es el mas utilizado para los materiales de laboratorio. el vidrio pyrex es el predilecto por su resistencia. ejemplo de estos son: Matraz aforado, Erlenmeyer, Probetas, pipetas
* Porcelana: Este material está constituido por
cerámica vitrificada, su resistencia química y mecánica son buenas, es otro de
los materiales mas utilizados en los laboratorios de química debido a su
neutralidad frente a los reactivos químicos y su gran resistencia a las altas
temperaturas, debido a esta última propiedad es que los crisoles son fabricados
de porcelana. Ejemplo de esto es: cristalizadores, capsulas de porcelana, embudo de buchner, mortero.
* Plástico: Las ventajas decisivas
de los plásticos son su resistencia a la rotura y su bajo peso. Sus propiedades
físicas y químicas varían notablemente según su composición.
El material también se clasifica en volumetrico y no volumetrico.
los instrumentos volumetricos son aquellos que vienen ya calibrados y solo pueden resistir una temperatura máxima de 20°c, si se pasa de esta temperatura se descalibra y su resultado sera inexacto. entre estos están: Matraz aforado, pipeta, probeta, bureta, pipeta graduada.
El material no volumetrico puede soportar temperaturas muy altas y no corre riesgo de descalibrarse, este es el que se utiliza cuando se necesita elevar una sustancia a una temperatura muy alta. en este grupo están: vasos de precipitados, erlenmeyer, cristalizadores.
Suscribirse a:
Entradas (Atom)




.jpg)
























